摘要
胆管癌是一种少见的原发性胆道恶性肿瘤,预后较差,根治性切除仅适用于少部份早期确诊的患者,大部份失去手术机会的患者采取胆道引流的姑息治疗方式治疗。胆道缓解引流是一种采用经皮或内镜插入的内镜置管术,可减轻患者骚痒、胆管炎和疼痛等症状,提高患者生活质量,但是仅有少量文献报道胆道缓解引流可提高胆管癌患者的生存时间。光动力疗法(photodynamictherapy,PDT)是一种相对新的、局部的、微创的姑息治疗方法,PDT是通过能聚集在增生组织(或肿瘤)中的光敏剂分子,是治疗不可手术切除胆管癌的标准的辅助治疗方式。
关键词 光动力疗法;胆管癌
中图分类号:R454.2;R657.4;文献标识码: A文章编号:1003-9430(2012)03-0193-05
Photodynamic TherapyforUnresectable Cholangiocarcinoma
LIU Zhong-tao,WENYu,MIAOXiong-ying,XIONGLi
The Second XiangyaHospital,Central SouthUniversity,Changsha410011, China
ABSTRACT
Cholangiocarcinoma(CC) is a rare primary malignancy of the biliary tract with a dismal prognosis.Curative resection applies only to a small proportion of the patients diagnosed on the early stage.Palliative biliary drainage based on percutaneous or endoscopic inser-tion of endoprostheses can improve quality-of-life by reducing pruritis,cholangitis and pain, but isseldom reported to extend survival time.Being relatively new,photodynamic therapy(PDT) is alocal and minimally-invasive palliative strategy for unresectable CC.PDT uses a type of photosensitive molecule that accumulates in proliferating tissue such as tumors.Activation of the photosensitizer with the light of a specific wavelength will generate reactive oxygen species that leads to selective tumor-cell death.The procedures are gen-erally well tolerated.PDT has also been reported to have a favorable outcome as an adjuvant and neo-adjuvant therapy for CC.Although accumulated data and local expertise are limited,PDT can be regarded as a standardpalliative therapy for unresectable CC.
Keywords Photodynamictherapy;Cholangiocarcinoma
胆管癌是起源于胆道上皮的恶性肿瘤。从肝内胆管到肝胰管壶腹部的胆道系统都可发生。胆管癌根据发生的部位分为肝内胆管癌和肝外胆管癌,肝内胆管癌发生于肝实质内,肝外胆管癌发生于肝十二指肠韧带内的胆管树。肝外胆管又分为肝门部胆管癌和远端胆管癌。肝门部胆管癌又称为Klatskin肿瘤,发生于距肝总管分岔2cm内的胆管,而远端胆管癌累及中段或远端部分胆管。
胆管癌主要发生在肝门部胆管即Klatskin肿瘤(见图1)[1]。由于肝内胆管癌多为中心性,晚期肿瘤巨大,而肝外远端胆管癌可通过根治性手术或放置支架获得治疗或缓解。所以,以往认为,PDT不适用于此两种胆管癌的治疗,只适用于治疗肝门部及其胆总管的延伸部分的胆管癌。现在的观点是对于不可切除的胆管癌都可以采用PDT治疗。
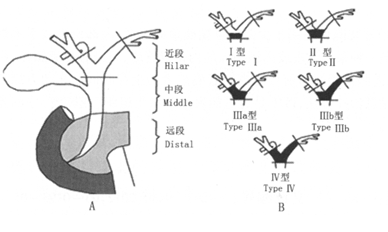
图1 Klatskin肿瘤的发生部位及类型
Fig. 1 Location and type of klatskintumor
Klatskin肿瘤的发生部位,远端肿瘤是胰腺内胆管的肿瘤,需要行胰十二指肠完全切除术(见 图1A)。Klatskin肿瘤的Bismuth-corlette分型(图1中黑色部分为肿瘤),Ⅰ型肿瘤位于肝总管分叉处,左右肝管之间相通;Ⅱ型肿瘤占据左右肝管汇合部,两者之间无通道;Ⅲ型肿瘤侵犯一侧肝管,累及右肝管 者为Ⅲa型,累及左肝管者为Ⅲb型;Ⅳ型肿瘤双侧肝管均受累(见图1B)。
肝内胆管的肿瘤,主要是造成区段性和肝内胆管的梗阻。虽然笔者着重讨论的是可能导致整个肝外胆道梗阻的肿瘤,但是将来也可将PDT用于治疗肝内胆管癌。而且后者的发病率有上升的趋势,且存在地域性的差别[2],最高发生率是在泰国的东北部(每10万 中 有96例)、中国以及东南亚其他地方,但有关肝外胆管癌的发病资料较少。
胆管癌是一种少见的肿瘤,占 消 化 肿 瘤 的3%[3]。尽管发生率较低,但是胆管癌的预后不良。因为胆管口径比较狭窄,胆管癌的组织标本采取很困难,特别是对于梗阻前的早期胆管癌,所以患者常常在出现胆道梗阻后才被诊断。近来,在行使经内镜逆行胰胆管造影时使用涂刷细胞的免疫荧光杂交可获得比较好的诊断结果,并且显示多染色体荧光杂交的敏感性(42.9%)显著高于常规细胞学检查,但是在临床上对胆管癌的诊断此方法没有广泛被应用[4]。因此,仅少数胆管癌患者能早期确诊采取根治性手术切除。胆管癌的根治性切除很难做到彻底,手术中胆管残端癌预后更差,术后的辅助治疗和化疗也不能对预后有明显的改善[5]。在胆管狭窄部位放置金属支架可改善患者的生活质量,但肿瘤向腔内再生长导致胆管梗阻。对于不可手术切除的胆管癌患者,缓解治疗常选择胆道支架引流,然而,经皮还是内镜放置支架引流,也只是短暂延长患者的生存时间[6]。再者,对于有经验的医师,肝门部胆管癌的此类干预手段的作用也非常有限,因为肿瘤会逐步侵犯许多肝内分支,放置支架引流的效果当然不理想[7]。PDT作为一种新兴的姑息治疗胆管癌的方法,能提高患者生活质量、解除梗阻及延长进展期胆管癌病人的生存期。
光动力疗法治疗胆管癌原理与方法
一、PDT的基本原理
PDT为在有氧的条件下导致细胞或组织发生一系列的生物反应[8]。其第一个成分是光敏剂,是一种能够聚集在靶细胞或组织的光敏分子;第二个成分是能激活光敏剂的某种特定波长的光。光敏剂在增生组织(如肿瘤)聚集后,然后暴露在某种特定波长的光下,激活并转移光能,从光到分子氧再到反应状态的单氧,从而引发一系列的生物反应。
二、胆管癌的光动力学治疗方法
1.光敏剂光卟啉是一种卟啉的衍生物,已经广泛使用于PDT治疗胆管癌。它是一个超过8个卟啉环的低聚混合物,其激活光的波长为630nm,给药浓度是2mg / kg,一般在静脉注射48h后可暴露于光照下进行PDT治疗,40~72h后正常的大部分组织的光卟啉会被广泛清除,但光卟啉仍然很长的时间聚集在肿瘤和皮肤组织里。光卟啉为第一代光敏剂,广泛运用于各种肿瘤的PDT治疗。光卟啉的不足是具有皮肤光敏毒性,患者在进行治疗时需要长时间避光,其光吸收波长低于630nm,而不能达到较大的组织渗透,对肿瘤组织的杀伤深度不够。此后,替莫泊芬、5-氨基酮戊酸、罗他泊芬等光敏剂在临床上都取得了较好的效果。特别像紫红素、苯并卟啉衍生物的激发光的波长分别达到了660和690nm,吸收波长红移,对组织的穿透性大大增强,且聚集和清除的速度快,缩短了给药到光照的时间间隔,减少了皮肤的光毒性。在第二代光敏剂的基础上交联各种载体,以进一步提高光敏剂对肿瘤的选择性的第三代光敏剂,尚处于试验阶段。这些载体简单的如多聚体和脂质体,复杂的如肿瘤表达的抗原或受体的相应抗体和配体[9]。
2.光源胆管癌因胆管位置较深,且属于管道系统的肿瘤,PDT治疗选择好合适的光源对于其治疗效果有较大的影响。目前,临床上治疗胆管癌的PDT激光光源一般是氩离子染料激光和半导体激光。氩离子染料激光的波长是630nm,可适用激发几种光敏剂。半导体激光是可调节波长的激光,其波长范围较宽,一般为630~980nm,比较适合于一些新的吸收波长较长的光敏剂,这种激光穿透组织能力较强,具备对更深层次的组织病变治疗功能。其光照能量密度一般是154~242J / cm2。照射功率密度为100~400mW / cm2[10]。
3.治疗步骤PDT分两步完成。首先给患者静脉注射光敏剂,给药后避光。48~72 h后对病灶区进行激光照射。PDT治疗胆管癌时需先经皮肝胆道引流或内镜逆行胆道引流途径放置支撑管,再经支撑管导入光导纤维进行激光照射。在进行内镜逆行性造影时,可产生光辐射。因此,在内镜逆行性造影之前需要确定肿瘤的近端和远端位置,并且确定其长度(用内镜视镜直径作为参考)[11]。PDT治疗后,需要放置一个10 F或是11. 5 F的塑料胆道支架到治疗部位,以确保胆管引流。经皮引流或是经内镜逆行性造影胆管插管失败的患者,可以经皮胆管 行PDT治疗,但是其相关实验研究报道较少[12]。
三、PDT姑息治疗不可切除胆管癌的临床应用首例PDT治疗胆管癌获得超过4年生存期优势后,陆续出现PDT治疗进展期胆管癌的报道[13]。最初为Bismuth分期Ⅲ~Ⅳ期的不可手术切除的肿瘤患者,显 示 了PDT治 疗胆管癌的安全性和可行性。其中两项研究(分别包括9和10例患者)报道平均生存期分别为439d和330d,1年生存率分别为75%和45%。随后,又有四项相关性前瞻性Ⅱ期研究报道。
Harewood等[9]治疗8例不可手术切除的胆管癌患者(患者平均年龄70. 5岁,BismuthⅢ期5例,Ⅳ期2例,都有血管和淋巴转移),内镜逆行胰胆管造影确定肿瘤的近端和远端,静脉输注卟吩姆纳2mg / kg,48h后,使用一种圆柱形扩散激光光纤通过内镜技术,经胆道结构到达肿瘤部位,用氩离子染料激光器照射,照射功率是密度400mW / cm2,能量密度180 J / cm2。患者平均接受2. 4次PDT治疗,随访直至患者死亡。患者的平均生存时间是276d。Du-mouli等[14]对24例Bismuth分期Ⅲ~Ⅳ胆管癌PDT治疗前瞻性研究,(平均年龄69.5岁,不可切除的胆管癌9例,因严重并发症而不适合手术的5例),并对符合纳入标准的对照组仅施行胆道引流。光敏剂、给药方法、以及光纤同Harewood,不同的是Du-mouli用630nm半导体激光器照射肿瘤部位,照射功率密度500mW / cm2,能量密度200J / cm2。PDT治疗组的平均生存期9. 9个月。Wiedmann等[15]应用PDT治疗23例患者(平均年龄68岁,BismuthⅢ期2例,Ⅳ期21例,19例有转移,4例无转移)。光敏剂是血卟啉衍生物,能量密度242J / cm2,给药浓度、操作步骤、激光器同Harewood。并进行了5年随访分析。有转移的患者平均生存期为9.3个月,无转移的患者平均生存期是11.2个月。Fuks等[16]以PDT治疗不可手术切除的胆管癌患者,取得同样可喜的结果。
Witzigmann等[17]应用PDT治疗124例肝门部胆管癌患者,对不可切除的患者都进行了双边胆道引流。静脉注射光敏剂卟吩姆纳2mg / kg后1~4d,在肿瘤部位给予激光光照,波长为630 nm,能量密度是242 J / cm2。作者比较了PDT组+支架组(n= 68,BismuthⅢ期14例、Ⅳ期53例,肿瘤分期Ⅲ期4例、Ⅳ期9例)和单独使用支架组(n= 56,Bis-muthⅢ期12例、Ⅳ期30例,肿瘤分期Ⅲ期1例、Ⅳ期8例)。两组在第1次治疗3个月后,PDT +支架组胆红素浓度下降显著(P<0. 001),相比于单独放置支架组的平均胆红素浓度要低(4.1mg / dlVS7. 3mg / dl) (P<0. 05)。75%的PDT +支架组患者成功引流,而在单独放置支架组仅有39%的患者成功引流。尽管PDT +支架组相对于单独放置支架组的BismuthⅣ期肿瘤病人比例较高(78%VS54%),但PDT +支架组患者的1年,2年生存率分别为51%和16%,而单独支架组仅分别为23%和10%。PDT+支架组患者的平均生存期为12个月。而单独支 架组患者的平均生存期为6. 4个月。这四个前瞻性研究都证明了患者行PDT治疗后,胆红素水平下降且获得了相对较好的生存期。
Ortner等[18]研究了39例患者在支架置入7 d后,胆红素水平下降没有超过50%,其中20例患者行PDT治疗,静脉注射光卟啉2mg / kg,48 h后,在肿瘤部位给予激光光照,波长为630 nm,能量密度是180 J / cm2,另19例患者未行PDT治疗。结果显示,PDT组患者的平均生存期是493d,非PDT组患者的平均生存期是98d,研究还表明PDT +支架治疗能降低胆红素水平,并且患者的身体功能和整个生活质量显著提高。
Zoepf等[19]在32例患者的随机对照试验中,进行双边胆管支架置入术的患者比例很低且患者的一般情况也较好。静脉注射光疗素-3 2mg / kg后48h,在肿瘤部位给予激光光照,波长为630 nm,能量密度是200 J / cm2。研究显示,在PDT组和单独内镜置管组患者的平均生存期分别是630d和210d。
Kahaleh等[20]挑选了48例经内镜放置支架超过5年的患者(平均年龄66. 6岁,Bismuth分期Ⅲ/Ⅳ期的患者36例),其中19例患者接受PDT治疗1. 6次。姑息治疗后,两组患者的胆红素水平均显著下降,并且下降的程度没有显著差异。PDT组患者的生存期平均(16. 2±2. 4)个月,单独放置支架组患者的生存期平均(7. 4±1.6)个月。
结论与展望
PDT作为治疗胆管癌的一个辅助方法,是安全有效的,特别是对不可手术切除的胆管癌患者,能提高患者的生存期,减轻黄疸,提升生活质量。国外已经有十多年的临床应用经验,疗效明确,但国内此方面的应用和研究较少。目前,对于PDT的免疫调节的作用,如何提高光化学反应效应以及PDT联合其他手段治疗胆管癌的疗效的研究还比较少。寻求PDT治疗胆管癌更理想的光敏剂,也是今后的研究重点。随着毒性低,疗效好的新型光敏剂的不断研发,先进激光技术的应用,加之与其他治疗方法的联合使用,PTD无疑会在今后胆管癌,特别是可不切除胆管癌的综合治疗中发挥更重要作用。
参考文献
[1]Ron R,Allison MD,EmmanuelZervos,etal.Cholangio-carcinoma:An emerging indication for photodynamic thera-py[J].Photodiagnosis and Photodynamic Therapy,2009,6:84-92.
[2]柴新群,安丹,冯贤松.胆管癌的流行病学与危险因素
[J].肝胆外科杂志,2008,16:316-317.
[3]叶松,黄蕾.向小东.光动力学疗法治疗胆管癌[J].中国激光医学杂志,2008,17:213-217.
[4]Fritcher EG,Kipp BR,Halling KC,etal. A multivariable model usingadvanced cytologic methods for the evaluation of indeterminate pancreatobiliary strictures[J].Gastroen-terology,2009,136:2180-2186.
[5]Khan SA,Davidson BR,Goldin R,etal,Guidelines for the diagnosis and treatment of cholangiocarcinoma:con-sensusdocument[J].Gut,2002,51:1-9.
[6]Paik WH,Park YS,Hwang JH,etal.Palliative treatment with self-expandable metallic stents in patients withad-vanced type Ⅲ or Ⅳ hilar cholangiocarcinoma: a percuta-neous versus endoscopic approach[J].Gastrointest En-dosc,2009,69:55-62.
[7]Baron TH.Photodynamic therapy:standard of care for pal-liation ofcholangiocarcinoma[J]?Clin Gastroenterol Hep-atol,2008,6:266-267.
[8]Dolmans D,Fukumura D,JainR.Photodynamic therapy for cancer[J].NatRevCancer,2003,3:380-387.
[9]邓小峰,苗雄鹰,熊力,等.光动力技术治疗脑肿瘤的进展[J].中国激光医学杂志,2011,20:323-327.
[10]Harewood GC,Baron TH Rumalla A,et al,Pilot study to assess patient outcomes following endoscopic application of Photodynamic therapy for advanced[J].JGastroenterol Hepatol,2005,20:415-420.
[11]Rumalla A,Baron TH,Wang KK,et al.Endoscopic ap-plication of photodynamic therapy for cholangiocarcinoma
[J].Gastrointest Endosc,2001,53:500-504.
[12]Prasad GA,Wang KK,Baron TH,et al.Factors associ-ated with increased survival after photodynamic therapy for cholangiocarcinoma[J].Clin Gastroenterol Hepatol,2007,5:743-748.
[13]Berr F,Wiedmann M,Tannapfel A,et al.Photodynamic therapy foradvanced bile duct cancer:evidence for im-proved palliation and extended survival[J].Hepatology,2000,31:291-298.
[14]Dumoulin FL,Gerhardt T,Fuchs S,et al.Phase Ⅱ study of photodynamic therapy and metal stent as pallia-tive treatment for nonresectablehilar cholangiocarcinoma
[J].Gastrointest Endosc,2003,57:860-867.
[15]Wiedmann M,Berr F,Schiefke I,et al.Photodynamic therapy in patients with non-resectable hilar cholangiocar-cinoma:5-year follow-up ofaprospective phase II study[J].Gastrointest Endosc,2004,60:68-75.
[16]Fuks D,Bartoli E,Delcenserie R,et al.Biliary drain-age,photodynamic therapy and chemotherapy for unre-sectable cholangiocarcinoma with jaundice[J]. J Gastro-enterol Hepatol,2009,24:1745-1752.
[17]Witzigmann H,Berr F,Ringe lU,et al.Surgical and palliative management and outcome in 184 patients with hilar cholangiocarcinoma: palliative photodynamic therapy plus stenting is comparable to r1 /r2 resection[J].Ann Surg,2006,244:230-239.
[18]Ortner ME,Caca K,Berr F,etal.Successful photody-namic therapy for nonresectable cholangiocarcinoma: a randomized prospective study[J].Gastroenterology,2003,125:1355-1363.
[19]Zoep fT,Jakobs R,Arnold JC,et al.Palliation of nonre-sectable bile duct cancer improved survival after photody-namic therapy[J].Am Gastroenterol,2005,100:2426-2430.
[20]Kahaleh M,Mishra R,Shami VM,et al.Unresectable cholangiocarcinoma: comparison of survival in biliary stenting alone versus stenting with photodynamic therapy[J].Clin Gastroenterol Hepatol,2008,6:290-297.


